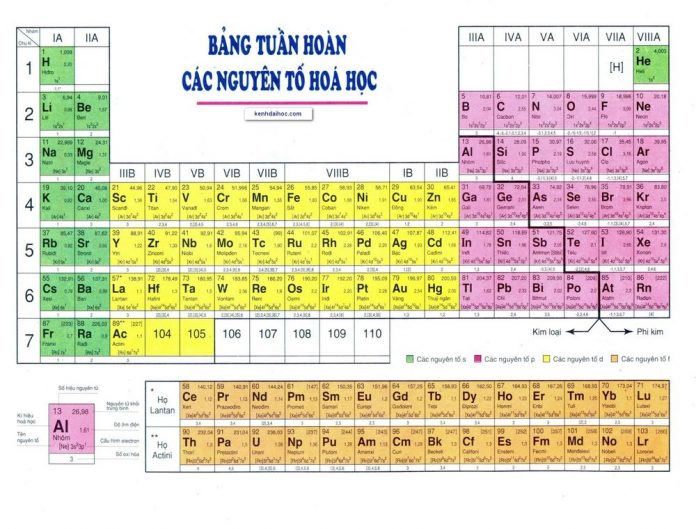
Đối với chương trình hóa học 8 các bạn cần phải chú ý nhiều đến các nguyên tố hóa học. Bảng nguyên tố hóa học 8 và ý nghĩa của chúng dưới đây chắc chắn sẽ giúp ích cho bạn trong quá trình học tập đấy!
1. Bảng nguyên tố hóa học 8 và một số công thức tính toán
1.1. Bảng các nguyên tố hóa học 8
Các nguyên tố hóa học 8 bạn cần lưu ý các nguyên tố sau:
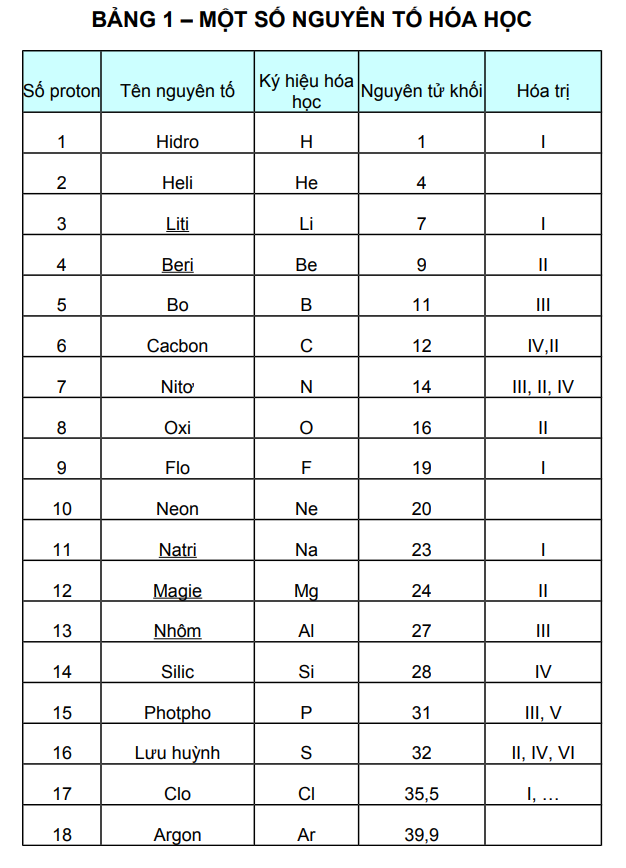
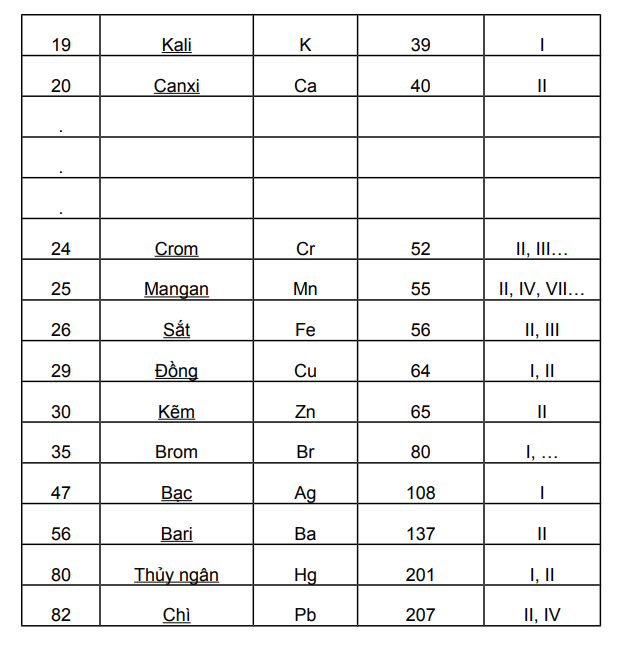
1.2. Một số công thức tính toán
Ta có: n= m/M Trong đó: m là khối lượng
m= n.M M là khối lượng mol
M= m/n n là số lượng mol
—–
n= V/22,4 Trong đó: Thể tích chất khí (lit)
V= n.22,4
—–
d(A/B)=MA/MB Trong đó: MA là khối lượng mol chất khí A
MB là khối lượng mol chất khí B
d(A/B) là tỷ khối chất khí A so với chất khí Bảng
—–
C%= (mct/mđ).100% Trong đó: C% là nồng độ dung dịch
mct là khối tan (g)
mdd là khối lượng dung dịch (g)
—–
CM= n/ V Trong đó: CM là nồng độ mol của dung dịch
n là số mol chất tan trong dung dịch
V là thể tích dung dịch
——
mdd= D. Vdd Trong đó: D là khối lượng riêng của dung dịch(g/ml)

2. Ý nghĩa bảng nguyên tố hóa học lớp 8
2.1. Quan hệ giữa vị trí của nguyên tố và cấu tạo nguyên tử của nó
Để hiểu được quan hệ giữa vị trí của nguyên tố và cấu tạo nguyên tử của nó chúng ta sẽ cùng đi vào ví dụ cụ thể sau đây nhé!
VD: Cho nguyên tố có STT 20 thuộc chu kì 4, nhóm IIA. Hãy xác định
– Số proton, số electron trong nguyên tử?
– Số lớp electron trong nguyên tử?
– Số eletron lớp ngoài cùng trong nguyên tử?
Lời giải:
– Nguyên tử có 20p, 20e
– Nguyên tử có 4 lớp e
– Số e lớp ngoài cùng là 2
Từ đó có thể suy ra là nguyên tố Ca
Từ ví dụ ta có thể rút ra kết luận: Khi biết vị trí của một nguyên tố trong bảng tuần hoàn thì có thể suy ra cấu tạo của nguyên tố đó và ngược lại.
-Số thự tự của chu kì « Số lớp electron.
-Số thứ tự của nguyên tố « Số proton, số electron
-Số thứ tự của nhóm A « Số electron lớp ngoài cùng.
2.2. Quan hệ giữa vị trí và tính chất của nguyên tố hóa học
Khi biết vị trí một nguyên tố trong bảng tuần hoàn có thể suy ra những tính chất hóa học cơ bản của nó:
– Tính kim loại, tính phi kim:
+ Nguyên tố ở các nhóm IA, IIA, IIIA (trừ H và B) có tính kim loại.
+ Nguyên tố ở các nhóm VA, VIA, VIIA (trừ antimon, bitmut và poloni) có tính phi kim.
– Hóa trị cao nhất của nguyên tố trong hợp chất với oxi, hóa trị của nguyên tố trong hợp chất với hiđro.
– Công thức oxit cao nhất.
– Công thức hợp chất khí với hiđro (nếu có)
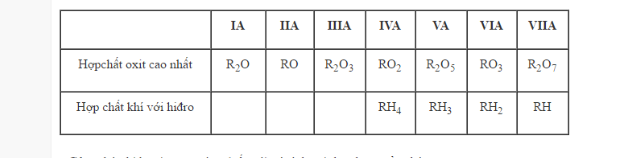
Công thức hiđroxit tương ứng (nếu có) và tính axit hay bazơ của chúng.
2.3. So sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận
Khi dựa vào qui luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn ta có thể so sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận.
Đi vào ví dụ cụ thể để dễ hiểu hơn nhé!
So sánh: P(Z=15) với Si(Z=14) và S(Z=16)
P(Z=15) với N(Z=7) và As(Z=33)
Ta có:
Nguyên tố Si, P, S thuộc cùng một chu kì => theo chiều tăng của Z => tính PK tăng dần Si < P < S
Nguyên tố N, P, As thuộc cùng nhóm A => theo chiều tăng của Z => tính PK tăng dần As < P < N
Bảng nguyên tố hóa học lớp 8 và ý nghĩa chắc chắn sẽ rất hữu ích cho bạn trong quá trình học và làm bài đấy, chúc các bạn học tốt!