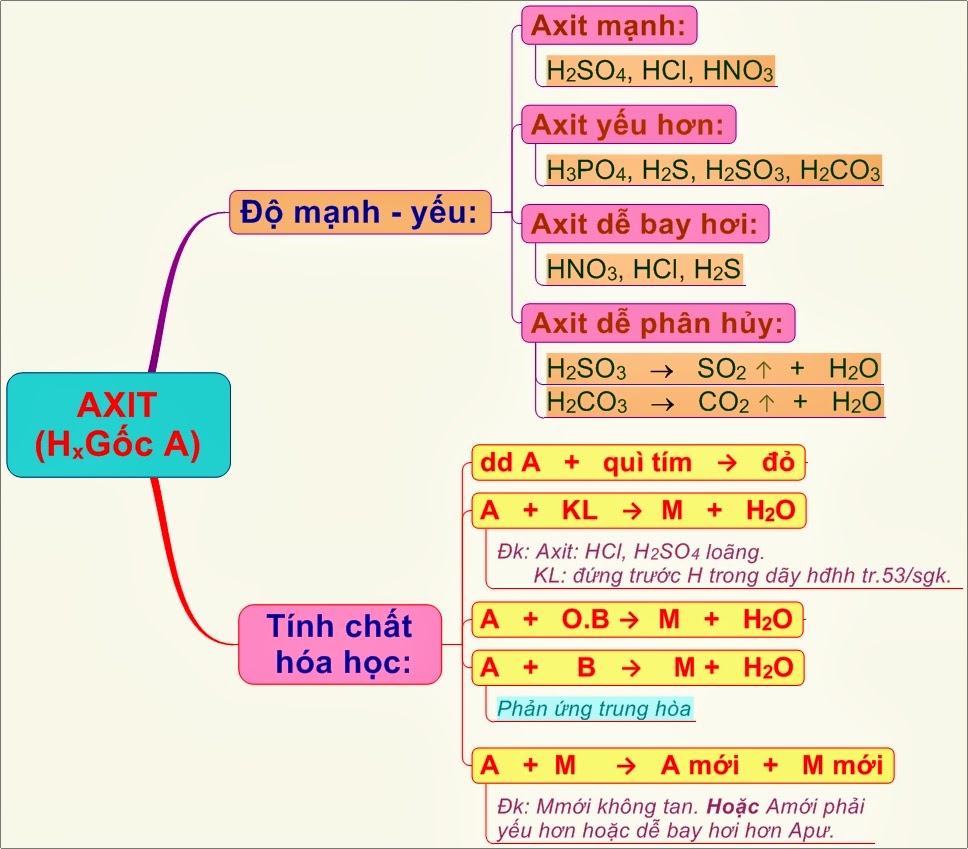
Từ lớp 8 học sinh đã được tìm hiểu về khái niệm axit, vậy các axit được gọi tên như thế nào, được phân loại ra sao, tính chất hóa học của axit có gì nổi bật. Hãy cùng 60s.edu.vn tìm hiểu bài viết sau đây. Về cơ bản Axit có những tính chất hóa học làm đổi màu giấy quì tím thành đỏ, tác dụng với kim loại, với bazơ, oxit và muối.
I. Khái quát cơ bản về axit:
Axit là hợp chất có một hay nhiều nguyên tử hidro liên kết với một hay nhiều gốc axit.
– Axit yếu:
+ H2CO3: axit cacbonic
+ H2S: Axit sunfuhidric
– Axit mạnh:
+ HCl: Axit clohidric
+ HNO3: Axit nitric
+ H2SO4: Axit sunfuric
– Axit có 5 tính chất hóa học đặc trưng:
+ Tác dụng với kim loại
+ Tác dụng với muối
+ Tác dụng với bazơ
+ Làm đổi màu quì tím
+ Tác dụng với oxit bazơ

II. Các tính chất hóa học của axit:
1. Tính chất hóa học của Axit: Axit làm đổi màu giấy quì tím:
– Ở điều kiện nhiệt độ, độ ẩm bình thường, giấy quỳ tím có màu tím, nhưng nó sẽ bị đổi màu khi cho vào các môi trường (axit, bazơ) khác nhau. Ở môi trường axit giấy quỳ tím chuyển màu thành đỏ, trong môi trường kiềm bazơ giấy quỳ tím chuyển sang màu xanh.
– Vì vậy dung dịch axit làm đổi màu giấy quỳ tím sang đỏ
– Đây cũng chính là cách đơn giản để nhận biết ra dung dịch axit, phục vụ trong các bài nhận biết.
2. Tính chất hóa học của Axit: Axit tác dụng với kim loại:
– PTPU: Axit + kim loại -> muối + H2
– Điều kiện phản ứng hóa học:
Axit: thường dùng là HCl, H2SO4 loãng (nếu là H2SO4 đặc thì không giải phóng H2 mà sinh ra các khí như CO, CO2, SO2….)
Kim loại: Muối tạo bởi các kim loại đứng trước H trong dãy hoạt động hóa học của kim loại
Dãy hoạt động hóa học của kim loại:
K … Na …..Ca ….Mg ….Al …Zn … Fe … Ni… Sn … Pb … H … Cu … Hg… Ag… Pt…. Au
Khi … nào ..cần…may… áo… Záp …sắt. ..nên…sang… phố … hỏi.. cửa …hàng… á.. phi…. âu
– Ví dụ:
2Na + 2HCl → 2NaCl + H2
Mg + H2SO4(loãng) → MgSO4 + H2
– Chú ý: Sắt khi phản ứng với HCl, H2SO4 loãng tạo muối sắt (II) chứ không sinh ra muối sắt (III)
3. Tính chất hóa học của Axit: Tác dụng với bazơ:
– PTPU: Axit + Bazơ -> muối + H2O
– Điều kiện: Tất cả các axit đều tác dụng với bazơ và được gọi là phản ứng trung hòa
– Ví dụ:
NaOH + HCl → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2+ 2H2O
4. Tác dụng với oxit bazơ:
– PTPU: Axit + oxit bazơ -> muối + Nước
– Điều liện: Tất cả các axit đều tác dụng với oxit bazơ.
– Ví dụ:
Na2O + 2HCl → 2NaCl + H2
CuO + 2HCl → CuCl2 + H2O
5. Tính chất hóa học của Axit: Tác dụng với muối:
– Nguyên tắc: Muối (tan) + Axit (mạnh) → Muối mới (tan hoặc không tan) + Axit mới (yếu hoặc dễ bay hơi hoặc mạnh).
– Điều kiện:
Muối tham gia tan, Axit mạnh, muối tạo thành không tan trong axit sinh ra
Sau phản ứng, nếu muối mới là muối tan thì axit mới phải yếu, nếu muối mới là muối không tan thì axit mới phải là axit mạnh
Chất tạo thành có ít nhất 1 kết tủa hoặc một khí bay hơi
– Ví dụ:
K2CO3 + 2HCl → 2KCl + H2O + CO2 (H2CO3 phân hủy ra H2O và CO2)
Tất cả tính chất hóa học cơ bản của Axit được TKBOOKS tổng hợp qua hình ảnh sau: