Phản ứng oxi hóa khử là một trong những kiến thức quan trọng trong chương trình hóa học Trung học phổ thông. Làm thế nào để nắm vững được các kiến thức 60s.edu.vn xin chia sẻ tới tất cả các em học sinh bài tập phản ứng oxi hóa khử lớp 10.
I. Cách làm bài tập phản ứng oxi hóa khử lớp 10 hay nhất
1. Xác định chất oxi hóa và chất khử trong cách làm bài tập phản ứng oxi hóa khử
A – Kiến thức cần nắm vững
Phản ứng oxi hóa – khử là phản ứng hóa học mà có sự thay đổi số oxi hóa của một số nguyên tố.
– Chất khử (chất bị oxi hóa) là chất nhường electron.
– Chất oxi hóa (chất bị khử) là chất nhận electron.
– Quá trình oxi hóa (sự oxi hóa) là quá trình nhường bớt electron.
– Quá trình khử (sự khử) là quá trình nhận them electron.

II – Bài tập về phản ứng oxi hóa khử
Bài 1/ Xác định phương ứng nào sau đây là phản ứng oxi hóa – khử. Chỉ ra chất oxi hóa và chất khử trong các phản ứng sau. Cân bằng các phương trình theo phương pháp cân bằng electron
- NH3 + O2 –> N2 + H2O
- H2S + O2 –> SO2 + H2O
- H2S + NaOH –> Na2S + H2O
- NH3 + HCl –> NH4Cl
- H2S + Cl2 + H2O –> H2SO4 + HCl
- HNO3 + Mg –> Mg(NO3)2 + NO + H2O
- H2SO4 + BaCl2 –> BaSO4 + HCl
- NH3 + O2 –> NO + H2O
- FexOy + Al –> Fe + Al2O
- CaO + H2O –> Ca(OH)2
- CaCO3 + HCl –> CaCl2 + CO2 + H2
- SO3 + H2O –> H2SO4
- CO2 + Ca(OH)2 –> CaCO3 + H2O
- KMnO4 –> K2MnO4 + MnO2 + O2
- Ca + H2O –> Ca(OH)2 + H2
Bài 2/ Biểu diễn sơ đổ e biểu diễn các quá trình biến đổi số oxi hóa, sau đó cho biết quá trình oxi hóa, quá trình khử diễn ra
- Cl+5 à Cl-1 à Cl+7 –> Cl+x/y à Cl0
- S-2 –> S+4 –> S+6 à S+x/y –> S0
- N-3 –> N0 –> N+2 –> N+3 –> N+4 –> N+5 –> N+4 –> N+3
Cân bằng bài tập phản ứng oxi hóa khử lớp 10
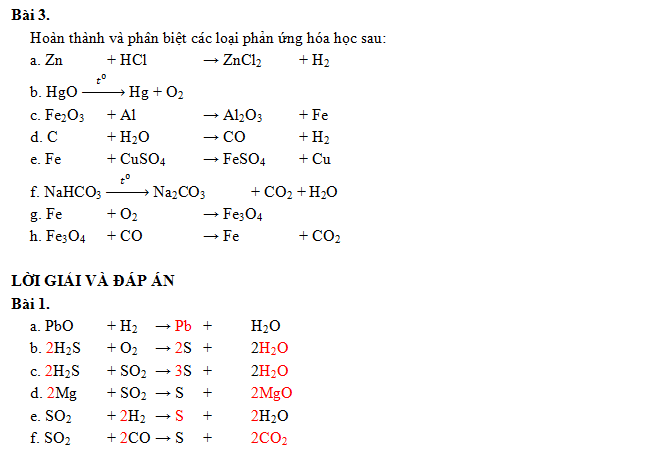
A – Kiến thức cần nắm vững khi cân bằng
Bước 1: Xác định số oxi hóa của các nguyên tử nguyên tố trong phản ứng để tìm chất oxi hóa, chất khử.
Bước 2: Hoàn thiện quá trình oxi hóa, quá trình khử, sau đó cân bằng mỗi quá trình.
Bước 3: Tính hệ số thích hợp cho chất oxi hóa, chất khử đảm bảo tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hóa nhận.
Bước 4:
– Viết các hệ số của chất oxi hóa, chất khử vào trong sơ đồ phản ứng, qua đó tính ra hệ số của các chất khác có trong phương trình hóa học.
– Kiểm tra cân bằng số nguyên tử của các nguyên tố và cân bằng điện tích hai vế để hoàn tất việc lập phương
trình hóa học của phản ứng
B – Bài tập
Bài 1/ Thực hiện cân bằng các phương trình sau theo phương pháp thăng bằng electron:
- NH3 + O2 NO + H2O
- NH3 + O2–> N2 + H2O
- FeI2 + H2SO4–>Fe2(SO4)3 + SO2 + I2 + H2O
- H2S + O2–> S + H2O
- Fe2O3 + CO–> Fe3O4 + CO2
- P + KClO3 –> P2O5 + KCl
- P + H2SO4 (đ) –> H3PO4 + SO2 + H2O
- Al + Fe2O3–> Al2O3 + FenOm
- Cu + HNO3(l) –> Cu(NO3)2+ NO + H2O
- P + HNO3 (loãng )+ H2O–> H3PO4 + NO
- MnO2 + HC–> MnCl2 + Cl2 + H2O












