Rất nhiều học sinh hoang mang không phân biệt được một số khái niệm về axit, bazơ hay muối nên rất thiếu tự tin về môn hóa học. Để giải quyết tận gốc vấn đề này, 60s.edu.vn xin chia sẻ kinh nghiệm xương máu về tính chất hóa học của Bazơ, các bài tập liên quan đến Bazo trong các đề thi, kiểm tra.
I.Khái niệm và phân loại, tính chất hóa học của Bazơ
– Bazơ là hợp chất phân tử có một nguyên tử kim loại kết hợp với một hay nhiều nhóm hidroxit (OH).
– Số nhóm hidroxit bằng hóa trị của kim loại
– Tên bazơ = tên kim loại (kèm theo hóa trị, với kim loại có nhiều hóa trị) + hidroxit
Ví dụ:
Fe(OH)3: Sắt (III) hidroxit
NaOH: Natri hidroxit
Ca(OH)2: Canxi hidroxit
– Theo tính tan của bazơ trong nước, chia bazơ thành 2 loại:
+ Bazơ tan ( các bazơ tan được trong nước tạo thành dung dịch bazơ kiềm ):
Ví dụ: NaOH, Ba(OH)2, Ca(OH)2, RbOH, CsOH, Sr(OH)2, KOH, LiOH.
+ Bazơ không tan ( Bazo không tan được trong nước ):
Ví dụ: Mg(OH)2, Fe(OH)3, Al(OH)3, Cu(OH)2…
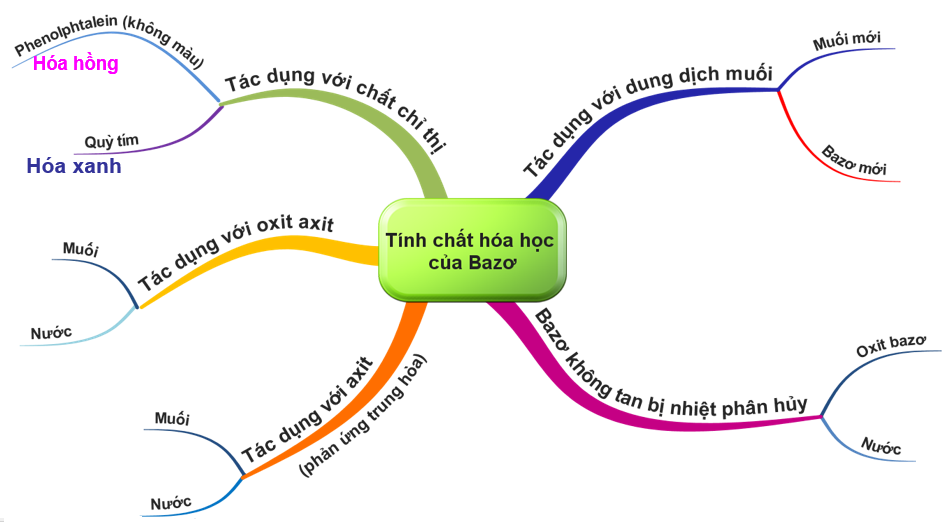
II. Tính chất hóa học của bazơ
1) Tính chất hóa học của bazơ: Làm thay đổi màu của chất chỉ thị màu quì tím, phenolphthalein.
– Dung dịch bazơ làm giấy quỳ tím đổi thành xanh.
– Dung dịch bazơ làm dung dịch phenolphthalein không màu đổi sang đỏ.
2) Dung dịch bazơ tác dụng với oxit axit sinh ra muối và nước.
Ví dụ: 2NaOH + SO2 → Na2SO3 + H2O
3) Bazơ tác dụng với dung dịch axit sinh ra muối và nước.
Ví dụ: Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
KOH + HCl → KCl + H2O
4) Dung dịch bazơ tác dụng với nhiều dung dịch muối tạo thành muối mới và bazơ mới.
Ví dụ: 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Chú ý: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan chính là điều kiện để phản ứng xảy ra.
5) Bazơ không tan bị nhiệt phân hủy sinh ra oxit và nước.
Ví dụ: Cu(OH)2 -> CuO + H2O
2Fe(OH)3 -> Fe2O3 + 3H2O
III. Bài tập vận dụng tính chất hóa học của bazơ
Bài 1: Sử dụng dung dịch Ca(OH)2, bằng cách nào để nhận biết được 3 loại phân bón: KCl, Ca(H2PO4)2, NH4NO3.
Bài 2: Có tất cả các bazơ sau: Mg(OH)2, KOH, Ba(OH)2. Em hãy cho biết những bazơ nào trong số đó:
a) Tác dụng với dd HCl. b) Bị nhiệt phân hủy thành oxit và nước.
c) Tác dụng với CO2. d) Đổi màu giấy quỳ tím thành xanh.
Bài 3: Hoàn thiện các phương trình phản ứng hóa học sau
a)..….->Fe2O3 +3H2O
b) H2SO4 +….–> MgSO4 + 2H2O
d) …… + CO2 –> Na2CO3 +H2O
e) CuSO4 + …… –> Cu(OH)2 + 2H2O
Bài 4: Viết phương trình phản ứng hóa học của H2O với:
a. Lưu huỳnh trioxit b. Cacbon đioxit
c. Điphotpho pentaoxit d. Canxi oxit e. Natri oxit
Bài 5: Viết phương trình phản ứng hóa học của Ca(OH)2 tác dụng với:
a. SiO2 b. SO3
c. HCl d. P2O5
Bài tập 6: Bằng phương pháp hóa học nhận biết các dung dịch sau: NaOH, HCl, H2SO4
Bài tập 7: Viết phương trình hóa học điều chế xút từ vôi sống và sôđa.
Bài tập 8: Cho 18,8 gam natri oxit NaO tác dụng với H2O, thu được 0,5 l dung dịch bazơ.
a) Viết phương trình hóa học sau đó hãy tính nồng độ mol của dung dịch bazơ thu được sau phản ứng.
b) Hãy tính thể tích dung dịch H2SO4 20% có khối lượng riêng D=1,14 g/ml vừa đủ để trung hòa dung dịch bazơ này.
Bài tập 9: Dung dịch X chứa 6,2g Natri hidroxit và 193,8g H2O. Cho dung dịch X vào 200g dung dịch Đồng II sunfat nồng độ 16% thu được a gam chất kết tủa .
a. Tính C% của dung dịch X.
b. Tính khối lượng a.
c. Tính lượng dung dịch HCl 2M cần dùng vừa đủ để hòa tan hết a gam kết tủa đó sau khi đã nung thành chất rắn đen.
Bài tập 10: Dùng dung dịch NaOH 40% trung hòa 300ml dung dịch H2SO4 1,5M
a. Em hãy tính khối lượng dung dịch NaOH cần dùng cho phản ứng trung hòa.
b. Dùng dung dịch KOH 5,6% (D = 1,045g/ml) thay dung dịch NaOH thì lượng KOH cần dùng cho phản ứng trung hòa là bao nhiêu?
IV. Đáp án
Bài 1:
Bước 1: Trích mẫu thử
Bước 2: Cho 3 loại phân bón vào 3 ống nghiệm có chứa dung dịch Ca(OH)2 sau đó đun nóng nhẹ
-Ống nghiệm có kết tủa trắng là dung dịch Ca(H2PO4)2
Ca(OH)2 + Ca(H2PO4)2 Ca3(PO4)3 + 4H2O
-Ống nghiệm có khí mùi khai bay ra là dung dịch NH4NO3:
Ca(OH)2 + 2NH4NO3 Ca(NO3)2 + 2NH3 +H2O
-Ống không có hiện tượng gì là dung dịch KCl
Bài 2:
a)Tất cả các bazơ đều phản ứng với dung dịch axit HCl:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
KOH + HCl → KaCl + H2O
b) Duy nhất Mg(OH)2 là bazơ không tan nên phân hủy bởi nhiệt:
Mg(OH)2 -> MgO + H2O
c) Các bazơ phản ứng với CO2 là Ba(OH)2 và KOH.
Ba(OH)2 + CO2 → BaCO3 + H2O
KOH + CO2 → K2CO3 + H2O
d) Các bazơ đổi màu quỳ tím thành màu xanh là Ba(OH)2 và KOH .
Bài 3:
Fe(OH)3 → Fe2O3 +3H2O
H2SO4 + Mg(OH)2 → MgSO4 + 2H2O
2NaOH + CO2 → Na2CO3 +H2O
NaOH +HCl → NaCl + H2O
CuSO4 + 2KOH → Cu(OH)2 + 2H2O
Bài 4:
SO3 + H2O –> H2SO4
P2O5 + 3H2O –> 2H3PO4
Na2O + H2O -> 2NaOH
CaO + H2O –> Ca(OH)2
Bài 5:
2KOH + SiO2 –> K2SiO3 + H2O
2KOH + CO2 –> K2CO3 + H2O
b. 2KOH + SO3 –> K2SO4 + H2O
d. 6KOH + P2O5 –> 2K3PO4 + 3H2O
Bài 6:
Bước 1: Trích mẫu thử:
Bước 2: Dùng quỳ tím để thử:
+ H2SO4, HCl làm quỳ chuyển màu đỏ
+ NaOH làm quỳ chuyển màu xanh
Bước 3: Dùng BaCl2 nhận 2 dung dịch axit:
+Không có hiện tượng gì là HCl
+Có kết tủa trắng là H2SO4
H2SO4 + BaCl2 → BaSO4 +2HCl
Bài tập 7:
– CaO + H2O –> Ca(OH)2
– Ca(OH)2 + Na2CO3 –> CaCO3 + 2NaOH.
Bài tập 8:
n K2O = = 0,2 mol
a) Khi cho K2O xảy ra phản ứng, tạo thành phản ứng dung dịch có chất tan là NaOH.
K2O + H2O → 2KOH
0,2 mol → 0,4 (mol)
Cm NaOH = 0,4/0,5 = 0,8M.
b) Phản ứng trung hòa dung dịch:
H2SO4 + 2KOH → K2SO4 + 2H2O
0,4 mol → 0,2 mol 0,4 (mol)
m H2SO4 = 0,25×98 = 24,5 g
M H2SO4 = 2+32+64 = 98g
Vdd = 85,96 ml
Bài tập 9:
n Na2O = 0,1 mol.
nCuSO4 = 0,2 mol
Na2O + H2O –> 2NaOH
0,1 mol 0,2 mol
Nồng độ % dung dịch NaOH:
C% = 0,2.40.1006,2+193,8 = 4%
2NaOH + CuSO4 –> Cu(OH)2 + Na2SO4
0,2 mol 0,1 mol 0,1 mol
a = 0,1. 98 = 9,8g
Cu(OH)2 → CuO + H2O
0,1 mol 0,1 mol
CuO + 2HCl → CuCl2 + H2O
0,2 mol 0,1mol
V HCl 2M : Vdd = n.V = 0,22 = 0,1 l
Bài 10:
a. Phương trình hóa học: H2SO4 + 2NaOH –> Na2SO4 + 2H2O
Số mol H2SO4 là: nH2SO4 = 0,3 . 1,5 = 0,45 mol
Khối lượng NaOH cần dùng: mNaOH = 2. 0,45. 40 = 36g.
Khối lượng dung dịch NaOH 40%: mdd = 36.10040 = 90g
b.Phương trình phản ứng: H2SO4 + 2KOH –> K2SO4 + 2 H2O
Khối lượng KOH cần dùng: mKOH = 2 . 0,45 . 56 = 50,4g
Khối lượng dung dịch KOH: mdd = 50,4.1005,6 = 900g
Thể tích dung dịch KOH cần dùng: vdd = mddD = 9001,045 = 861,2 ml